
- Автор Miles Stephen [email protected].
- Public 2023-12-15 23:38.
- Соңғы өзгертілген 2025-01-22 17:03.
жылы алмаз валенттік электрондар толық ковалентті байланысқан. Бірақ ішінде графит бір электрон еркін қозғалған кезде тек үшеуі ғана ковалентті байланысқан алмаздың балқу нүктесі болу керек қарағанда жоғары сол графит өйткені ішінде алмаз біз төрт коваленттік байланысты үзуіміз керек графит тек үш облигация.
Оның үстіне графиттің балқу температурасы алмазға қарағанда неге төмен?
жылы графит , әрбір көміртек атомы басқа үш көміртек атомымен коваленттік байланыс арқылы байланысқан. жылы алмаз әрбір көміртек атомы басқа төрт көміртек атомымен коваленттік байланыс арқылы байланысқан. Сондықтан бұл парадоксальды болып көрінеді алмаз болады төменгі балқу температурасы . Дегенмен, қабаттары графит делокализацияланған электрондарды қамтиды.
Сондай-ақ, алмастың балқу температурасы неге жоғары? Әрбір көміртек атомы басқа төрт көміртек атомымен ковалентті байланысқан. Атомдарды бөлу үшін көп энергия қажет алмаз . Бұл коваленттік байланыстардың күшті болғандықтан, және алмаз құрамында өте көп коваленттік байланыс бар. Бұл жасайды алмаздың балқу нүктесі және қайнау нүктесі өте жоғары.
Сондықтан графиттің балқу температурасы неге жоғары?
Дегенмен, графит әлі де бар жоғары балқу және қайнау нүктесі өйткені қабаттардағы көміртек атомдарын біріктіретін күшті коваленттік байланыстар үзілу үшін көп жылу энергиясын қажет етеді.
Неліктен алмаздың балқу температурасы натрий хлоридінен жоғары?
Облигациялар натрий хлориді олар жеткілікті күшті иондық байланыстар болып табылады, сондықтан ол өте жоғары Еру нүктесі 801С. Бұл өте күшті байланыстар және т.б алмаз (және графит) оңай емес еріген . Іс жүзінде бұл заттар жоқ балқыту бірақ асқақ (газ тәрізді көміртегі атомдарына айналады).
Ұсынылған:
Неліктен таза заттың балқу температурасы жоғары болады?

Молекула аралық күштердің рөлі Бұл күштер зат балқыған кезде бұзылуы керек, бұл энергия енгізуді қажет етеді. Энергияны енгізу жоғары температураға айналады. Сонымен, қатты денені ұстап тұрған күштер неғұрлым күшті болса, оның балқу температурасы соғұрлым жоғары болады
Неліктен судың балқу температурасы жоғары?
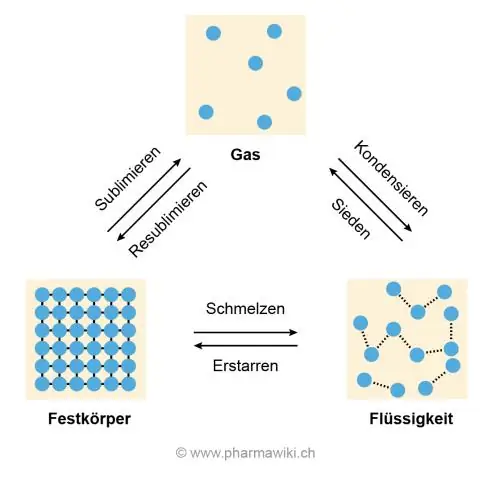
Балқу және қайнау температураларының жоғары болуының себебі су молекулалары арасындағы сутегі байланысы болып табылады, бұл олардың бір-біріне жабысып, ажырауға қарсы тұруына әкеледі, бұл мұз еріген кезде және су қайнағанда газға айналады
Неліктен натрийдің балқу температурасы жоғары?

Натрий хлориді жоғары балқу температурасына ие, өйткені оның оң және теріс иондары арасындағы күшті электростатикалық тартылыс; бұл жеңу үшін көбірек жылу энергиясын қажет етеді. Сондай-ақ оның үлкен тор құрылымы бар, яғни оның құрамында миллиондаған күшті иондық байланыстар бар
Неліктен алюминийдің балқу температурасы натрийге қарағанда жоғары?

Кезең бойы валенттілік артады (натрийдегі 1 валенттіліктен алюминийдегі 3 валенттілікке дейін), сондықтан металл атомдары оң зарядталған катиондарды және делокализацияланған электрондардың үлкен теңізін құру үшін көбірек электрондарды делокализациялай алады. Сондықтан металдық байланыс күшейеді және балқу температурасы натрийден алюминийге дейін артады
Неліктен судың қайнау және балқу температурасы жоғары?

Балқу және қайнау температураларының жоғары болуының себебі су молекулалары арасындағы сутегі байланысы болып табылады, бұл олардың бір-біріне жабысып, ажырауға қарсы тұруына әкеледі, бұл мұз еріген кезде және су қайнағанда газға айналады
