
- Автор Miles Stephen [email protected].
- Public 2023-12-15 23:38.
- Соңғы өзгертілген 2025-01-22 17:03.
Орбитальдар жылы энергияны арттыру тәртібі :1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 6f, т.б.
Сондай-ақ, орбиталардың энергия деңгейлерімен қандай байланысы бар екенін біліңіз?
Атомдағы электрондар спецификалық түрде болады энергетикалық деңгейлер (1, 2, 3 және т.б.) олар ядродан әртүрлі қашықтықта орналасқан. Әрқайсысының ішінде энергия деңгейі белгілі бір электрондар орналасуы мүмкін кеңістіктің көлемі. Бұл кеңістіктер деп аталады орбитальдар , әр түрлі пішінді, алеттер арқылы белгіленеді (s, p, d, f, g).
Сол сияқты қай орбитальдың энергиясы жоғары? Электрондық орбитальдар атомдар ішінде электрондары бар аймақтар ең жоғары табылу ықтималдығы.
Бұдан басқа, орбитальдарды толтырудың дұрыс тәртібі қандай?
1-ереже - Ең төменгі энергия орбитальдарды толтырады бірінші. Осылайша, толтыру үлгі 1s, 2s, 2p, 3s, 3p, 4s, 3d, т.б. орбитальдар ішкі қабықшаның ішінде азғындаған (тең энергия), белгілі бір заттың барлық ішкі қабығы орбиталық түрі болып табылады толтырылған жоғары энергияның келесі ішкі қабатына көшу алдында.
Энергия деңгейінің диаграммасы қандай?
Химиктер кейде энергия деңгейінің диаграммасы Олар химиялық реакциялар мен байланыстарды қарастырған кезде электрондарды көрсетеді. Химиктер пайдаланады энергия деңгейінің диаграммасы сондай-ақ қайсысын көрсету үшін асэлектронды конфигурация белгісі энергетикалық деңгей , ішкі қабықша және орбиталь кез келген белгілі бір атомда электрондар алады.
Ұсынылған:
Айналу кинетикалық энергиясының өлшем бірлігі қандай?
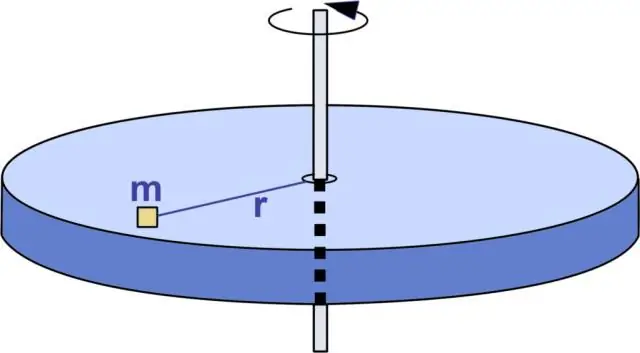
Кинетикалық энергияның өлшем бірлігі Джоуль (Дж). Басқа бірліктер тұрғысынан бір Джоуль секундына бір килограмм метр квадратқа тең (). Айналу кинетикалық энергиясының формуласы Сұрақтар: 1) Инерция моменті I = 1500 кг∙м2 дөңгелек диірмен тасы 8,00 радиан/с бұрыштық жылдамдықпен айналады
Өсу ерекшеліктері қандай?

Өсу органның немесе тіпті жеке жасушаның мөлшерінің қайтымсыз тұрақты ұлғаюы ретінде анықталады. Басқаша айтқанда, өсу - бұл энергия шығынымен жүретін әртүрлі метаболикалық процестермен бірге жүретін тірі денелердің ең негізгі сипаттамалары. Процестер анаболикалық немесе катаболикалық болуы мүмкін
Электр энергиясының механикалық энергияға қандай мысалдары бар?

Электр энергиясын механикалық энергияға түрлендіретін құрылғылардың мысалдары - басқаша айтқанда, бір нәрсені жылжыту үшін электр энергиясын пайдаланатын құрылғылар - мыналарды қамтиды: бүгінгі стандартты электр бұрғыларындағы қозғалтқыш. қазіргі стандартты электр араларындағы мотор. электр тіс щеткаларында қозғалтқыш. электромобильдің қозғалтқышы
Орбитальдардың ең көп саны қанша?

Бір орбиталмаксимумда екі электрон болуы мүмкін. s ішкі деңгейінде тек бір орбиталь бар, сондықтан максимум 2 электронды қамтуы мүмкін. p ішкі деңгейінде 3 орбиталь бар, сондықтан максимум 6 электронды қамтуы мүмкін. Қосалқы деңгейдің 5 орбитальдары бар, сондықтан 10 электрон макс болуы мүмкін
Өсімдіктердің өсу реттегіштерінің өсімдік ұлпаларын өсірудегі рөлі қандай?

Өсімдік ұлпасының культурасында өсу реттегіші өсімдіктің қалыптасуында және каллус индукциясында тамыр мен өркеннің дамуын бақылау сияқты маңызды рөлдерге ие. Цитокинин мен ауксин өсудің екі маңызды реттегіші болып табылады
