
- Автор Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:38.
- Соңғы өзгертілген 2025-01-22 17:03.
Хлор изотоп 18 нейтрондар молдығы 0,7577 және массалық саны 35 аму. Есептеу үшін орташа атомдық масса, бөлшекті әрқайсысы үшін массалық санға көбейтіңіз изотоп , содан кейін оларды бірге қосыңыз.
Сол сияқты, элементтің барлық изотоптарының орташа салмақты мәні қандай?
Әртүрлі массаларды пайдалану изотоптар және әрқайсысы қаншалықты көп изотоп яғни, таба аламыз орташа а атомдарының массасы элемент . а-ның атомдық массасы элемент болып табылады орташа өлшенген табиғи жағдайда кездесетін үлгідегі атомдардың массасы элемент . Атомдық масса әдетте атомдық масса бірліктерімен беріледі.
1 аму массасы нешеге тең? Атомдық масса бірлігі (таңбаланған AMU немесе amu) көміртегі-12 атомының массасының 1/12 дәлдігі ретінде анықталады. Көміртегі-12 (С-12) атомында алты бар протондар және алты нейтрондар оның ядросында. Нақты емес мағынада бір AMU орташа көрсеткіш болып табылады протон тыныштық массасы және нейтрон тыныштық массасы.
Екіншіден, атомдық массаны пайдаланып пайыздық молшылықты қалай есептейсіз?
Әрқайсысын өзгертіңіз пайыздық молшылық 100-ге бөлу арқылы ондық түрге. Бұл мәнді көбейтіңіз атомдық массасы сол изотоптан. Орташа мәнді алу үшін әрбір изотоп үшін бірге қосыңыз атомдық массасы.
Атомдық масса мен атомдық салмақтың айырмашылығы неде?
Атомдық масса (ма) болып табылады массасы бір атом . Жалғыз атом протондар мен нейтрондардың белгіленген саны бар, сондықтан массасы бұл сөзсіз (өзгермейді) және протондар мен нейтрондар санының қосындысы атомда . Атомдық салмақ -ның орташа салмақты мәні болып табылады массасы барлығынан атомдар изотоптардың көптігіне негізделген элемент.
Ұсынылған:
Екі жылдамдықпен орташа жылдамдықты қалай табуға болады?
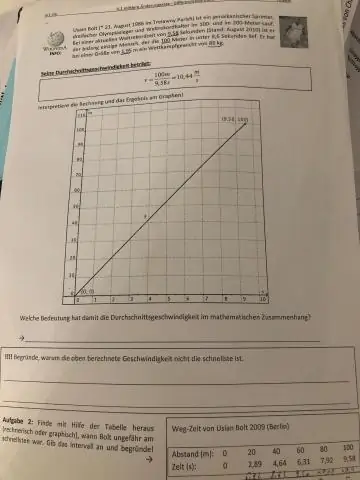
Орташа мәнді табу үшін бастапқы және соңғы жылдамдықтың қосындысы 2-ге бөлінеді. Орташа жылдамдық калькуляторы орташа жылдамдықтың (v) соңғы жылдамдықтың (v) және бастапқы жылдамдықтың (u) 2-ге бөлінген сомасына тең екенін көрсететін формуланы пайдаланады
Сұйық қоспаның меншікті салмағын қалай табуға болады?

Енді жалпы тығыздықты судың тығыздығына бөліңіз, сонда сіз қоспаның SG мәнін аласыз. Ең жоғары тығыздықтағы сұйықтық қандай? Көлемі бірдей екі затты араластырғанда қоспаның меншікті салмағы 4-ке тең. Тығыздығы p сұйықтың массасы басқа тығыздығы 3p сұйықтың бірдей массасымен араласады
Орташа берілгенде жетіспейтін санды қалай табуға болады?

Сандар жиынының орташа мәні сол сандардың орташа мәні болып табылады. Тақырыпты сандар жиынын қосу және берілген қанша санға бөлу арқылы табуға болады. Егер сізге тақырып беріліп, жиыннан жетіспейтін санды табу сұралса, қарапайым теңдеуді қолданыңыз
Орташа жылдамдық есебін қалай табуға болады?

(b) Орташа жылдамдық – жанама сызығының көлбеуі емес, секант сызығының еңісі. Орташа жылдамдықты табу оңай. Екі реттелген жұпты құру үшін көрсетілген аралық шекараларындағы нысанның биіктігін есептеу үшін позиция теңдеуіне t = 2 және t = 3 қосыңыз: (2, 1478) және (3, 1398)
Графикте орташа мәнді қалай табуға болады?
Орташа мәнді табу үшін сандарды қосып, қосындыларды қосылғыштар санына бөлу керек
